작성자 : 동글몽실
추천 : 0
조회수 : 1387회
댓글수 : 1개
등록시간 : 2011/07/27 21:09:59
어떤 곳에서는 (주로 일반화학책)
H2 A (aq) ⇄ H3O+ + HA- (aq)
HA- ⇄ H3O+ + A2- (aq) Ka2
일 때 Ka1>>Ka2 이므로 [H+] 는 H2 A (aq) ⇄ H3O+ + HA- (aq) 반응에 의해 결정된다고 하고 계산을 하고
(그러니깐 첫번째 반응으로 [H+]를 구하고 이에 다른 화학종들의 농도를 맞춰나가는 식)
어떤 곳에서는 (주로 학원강의 들을 때)
NaHCO3는 물에 녹아 HCO3- 이온과 Na+이온으로 완전히 나누인다. HCO3-이온은 그 중 일부분이 다음과 같은 두 가지 가수 분해 반응을 한다.
HCO3 + H2O = H3O+ + CO32-
HCO3- + H2 = H2CO3 + OH-
이들 반응은 각각 가역 반응으로서 평형 상태에 있다.
또 생겨난 H3O+ 와 OH-이온들은 H3O+ + OH- = 2H2O의 반응으로 거의 완전히 없어진다. 그러므로 위 두 반응이 오른쪽으로 진행되는 정도는 거의 같고, 따라서 묽은 NaHCO3 용액 중에서 CO32- 농도와 H2CO3의 농도는 같아진다.
요런 식으로 생각해서
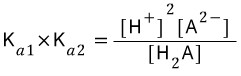
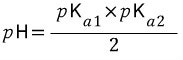
라고 생각하던데 어떤게 더 맞을까요?



