4895
2021-01-26 08:53:57
0
한국에서는 대형마트서 비슷하게 생긴걸 블랙사파이어 포도라고 팔더라구요.
4891
2021-01-24 23:33:33
40
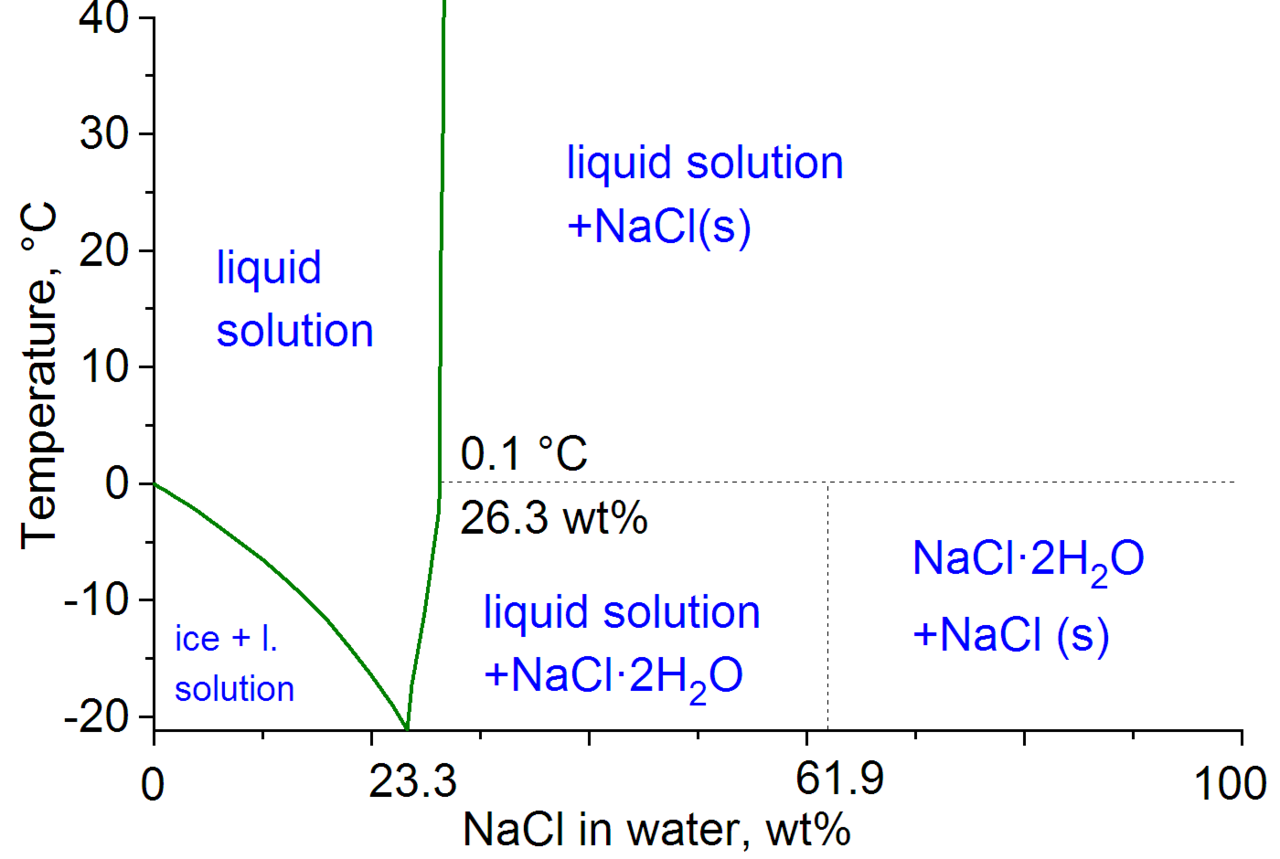
아... 상태도 찾아보면 되는걸 뻘짓했네요. -21.12도까지 내려갈수 있다네요. 그 이하는 얼음
4890
2021-01-24 23:19:43
48
어는점 내림 계산해보면
△Tf = Tf´ - Tf0 = - Kf ∙ m
내리는 온도차 = 용매 상수 * 몰랄농도
영하 25도 기준으로 잡고, 물의 상수는 1.86이니까
m= 25/1.86 = 13.44
염화나트륨으로 잡고 이온화되면 이온 2배니까 몰랄농도가 6.7 mol/kg이면되고
염화나트륨 분자량은 58.44g/mol이니까
1kg의 물에 390g 의 염화나트륨을 녹인 물이면 되는데.... 문제는 염화나트륨의 물에 대한 용해도가 대충 36% 정도되므로 360g 정도만 녹고 나머지는 석출됩니다. 결과적으로 영하 25도에서 소금물은 농도를 아무리 높여도 얼어버립니다.
염화나트륨 360g 녹인다 치고 반대로 계산해 올라가면 어는점 내림의 최대치는 대충 영하 23도 정도 되네요.
△Tf = Tf´ - Tf0 = - Kf ∙ m
내리는 온도차 = 용매 상수 * 몰랄농도
영하 25도 기준으로 잡고, 물의 상수는 1.86이니까
m= 25/1.86 = 13.44
염화나트륨으로 잡고 이온화되면 이온 2배니까 몰랄농도가 6.7 mol/kg이면되고
염화나트륨 분자량은 58.44g/mol이니까
1kg의 물에 390g 의 염화나트륨을 녹인 물이면 되는데.... 문제는 염화나트륨의 물에 대한 용해도가 대충 36% 정도되므로 360g 정도만 녹고 나머지는 석출됩니다. 결과적으로 영하 25도에서 소금물은 농도를 아무리 높여도 얼어버립니다.
염화나트륨 360g 녹인다 치고 반대로 계산해 올라가면 어는점 내림의 최대치는 대충 영하 23도 정도 되네요.
4889
2021-01-16 17:28:42
0
검침담당자가 귀찮아서 그냥 지난달하고 비슷하게 가라로 처리했다가 몇달만에 계량기 열어보니 숫자가 확 올라와 있어 한번에 돈내게 처리한 경우도 가끔 있긴 합니다...
4883
2020-12-21 17:50:09
0

달도 안보일정도로 구름이 가득 껴서 망했음
4882
2020-12-20 21:30:59
0
하늘도 맑고
사진 이쁘게 잘나왔네요ㅎㅎ
사진 이쁘게 잘나왔네요ㅎㅎ
4881
2020-12-20 20:34:01
0
촬영은 갤럭시s8 폰으로 아이피스에 대고 찍은거에요


